Cinética Enzimática
La cinética enzimática es una rama de la bioquímica que analiza la velocidad de las reacciones químicas catalizadas por enzimas. Estas proteínas especializadas permiten que las reacciones biológicas ocurran con eficiencia y precisión bajo condiciones suaves de temperatura y pH. Su estudio es fundamental para entender procesos metabólicos, diseñar medicamentos e implementar aplicaciones biotecnológicas. La actividad enzimática depende de diversos factores físicos, químicos y estructurales que pueden modificar o incluso inhibir la función catalítica.
Factores que afectan la Cinética Enzimática:
1. Concentración de sustrato :La relación entre velocidad de reacción y concentración de sustrato sigue una curva hiperbólica, descrita por la ecuación de Michaelis-Menten. A baja concentración, la velocidad aumenta proporcionalmente con el sustrato. Sin embargo, una vez saturados todos los sitios activos de la enzima, se alcanza un límite conocido como Vmax. Este conocimiento es fundamental en farmacología, por ejemplo, para diseñar dosis efectivas de fármacos que actúan como sustratos o inhibidores enzimáticos .

Tomada de:https://temas-selectos-de-ciencias.blogspot.com/p/cinetica-enzimatica.html
2. Temperatura
El aumento de la temperatura incrementa la energía cinética de las moléculas, favoreciendo los choques eficaces entre enzima y sustrato. Sin embargo, por encima de cierto umbral (usualmente entre 37–45 °C en humanos), la enzima puede desnaturalizarse, perdiendo su estructura tridimensional y funcionalidad. Por esta razón, las enzimas deben operar en rangos térmicos muy específicos, lo cual es relevante tanto en la fisiología humana como en procesos industriales como la fermentación .
3.pH del medio
Las enzimas poseen un pH óptimo en el que su estructura y el entorno del sitio activo son ideales para la unión del sustrato. Un cambio en el pH puede alterar las cargas eléctricas de aminoácidos clave, afectando la forma de la enzima y reduciendo su afinidad por el sustrato. Por ejemplo, la pepsina (enzima gástrica) funciona mejor a pH 2, mientras que la amilasa salival lo hace a pH cercano a 7. Estos rangos reflejan su localización y función en el cuerpo .
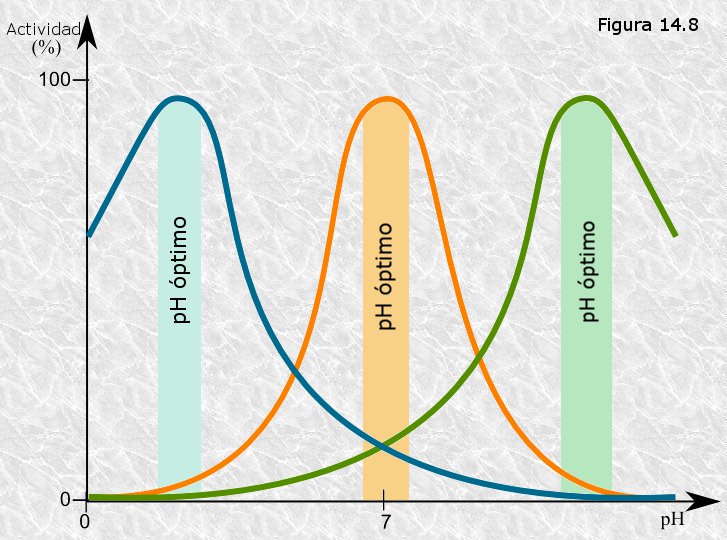
Tomado de: https://www.bionova.org.es/biocast/tema14.htm
4. Concentración de enzima
A mayor concentración de enzima, más sitios activos están disponibles para catalizar la reacción, siempre que haya sustrato suficiente. Esto se aplica en laboratorios y fábricas donde se ajustan las cantidades de enzimas para maximizar la producción.
Tomado de: https://www.bionova.org.es/biocast/tema14.htm
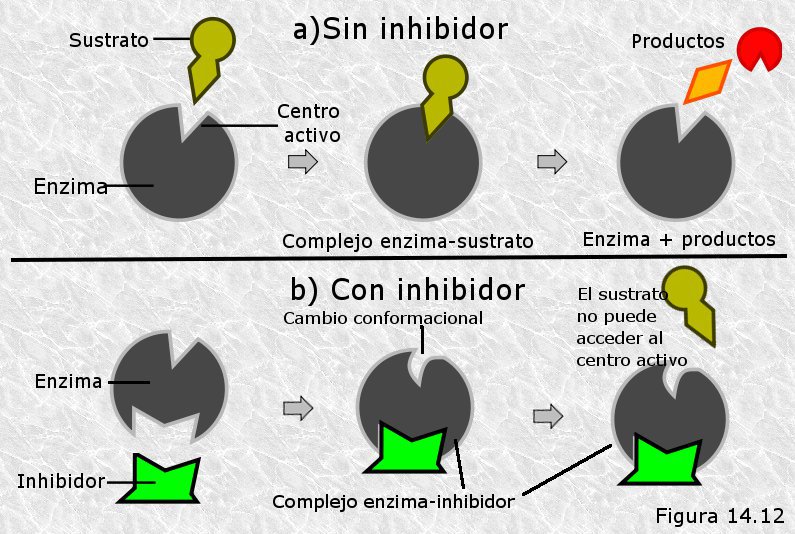
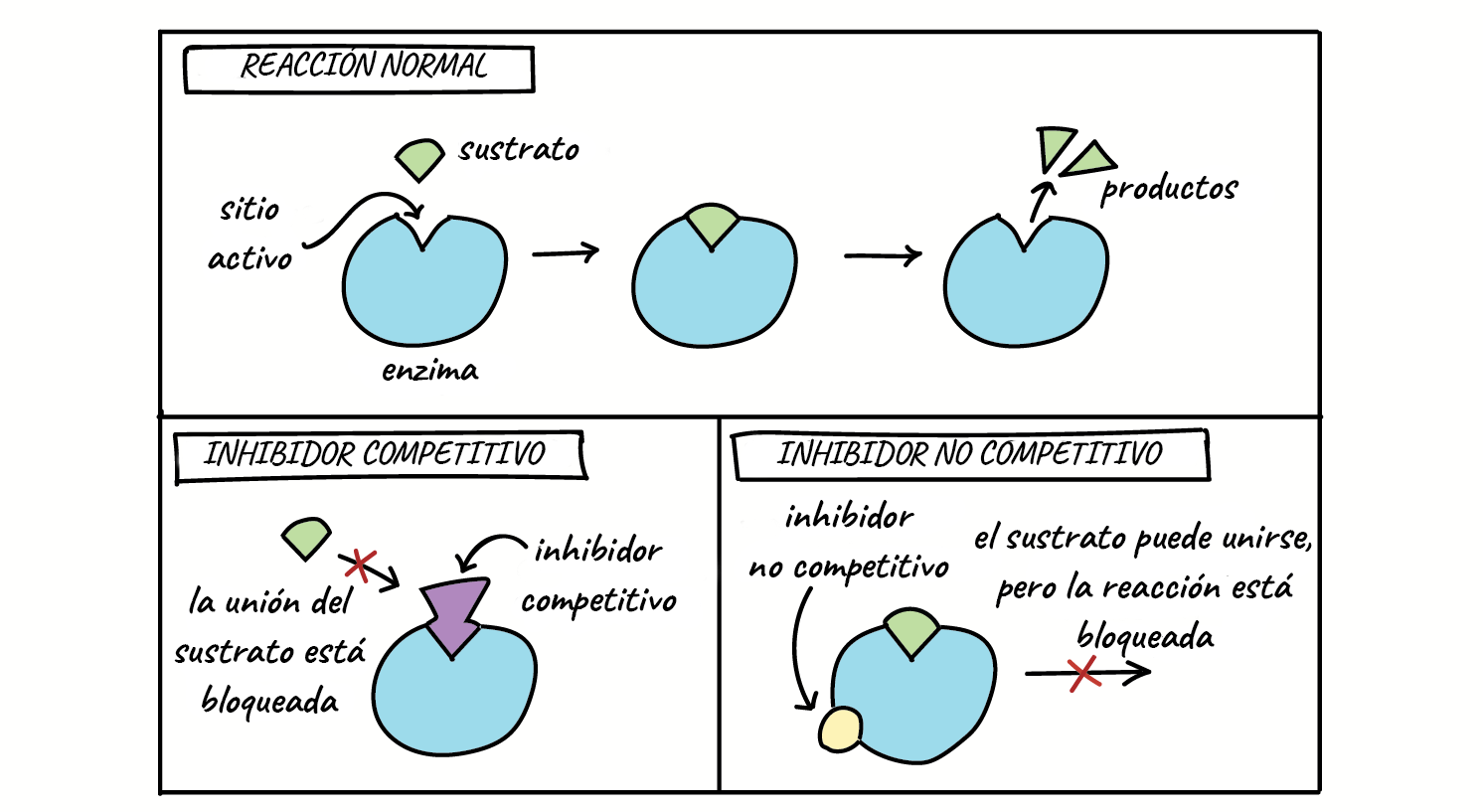
5. Inhibidores enzimáticos
- Competitivos: se parecen al sustrato y compiten por el sitio activo. Son reversibles y afectan la afinidad, aumentando el valor de Km.
- No competitivos: se unen a otras partes de la enzima, alterando su forma y reduciendo Vmax.
- Irreversibles: bloquean permanentemente la enzima. Son útiles en tratamientos médicos (como el ácido acetilsalicílico, que inhibe irreversible a la ciclooxigenasa) pero también pueden ser tóxicos (por ejemplo, algunos pesticidas o venenos) .
6. Cofactores y coenzimas:
Muchas enzimas requieren moléculas auxiliares para funcionar correctamente. Los cofactores pueden ser iones metálicos (Zn²⁺, Mg²⁺, Fe²⁺), mientras que las coenzimas son moléculas orgánicas (como el NAD⁺, FAD, Coenzima A). Sin estos componentes, la enzima no puede formar el complejo enzima-sustrato ni llevar a cabo la catálisis.
Tomado de: https://theory.labster.com/es/co-factor/
7.Fuerza del Ión:
La fuerza iónica del medio influye directamente en la actividad enzimática, ya que afecta las interacciones electrostáticas entre enzima y sustrato. Concentraciones iónicas muy altas o muy bajas pueden alterar la conformación del sitio activo o la estabilidad de la enzima. Esto puede disminuir su afinidad por el sustrato o incluso desnaturalizarla. Por ello, mantener un equilibrio iónico es clave para garantizar una catálisis eficiente.
Tomado de: https://humanidades.com/enzimas/
Conclusión:Las enzimas, con su asombrosa capacidad para acelerar las reacciones vitales del organismo, nos revelan la perfección del equilibrio biológico. Comprender cómo factores como el pH, la temperatura o la presencia de inhibidores afectan su funcionamiento no solo enriquece nuestro conocimiento científico, sino que también nos permite valorar la precisión con la que opera la vida. La cinética enzimática no es solo un tema de laboratorio: es la clave para entender enfermedades, diseñar medicamentos y mejorar procesos que impactan directamente en la salud, la industria y el ambiente. En cada reacción catalizada por una enzima, la naturaleza nos enseña que incluso lo más pequeño puede transformar lo más grande.
Referencias:Caamiña, M. P. V., Anaya, P. B., & De Bustamante, J. D. (2021). ¿Por qué paran las reacciones? Diseñar experimentos para indagar la interacción enzima-sustrato. Educación Química, 32(2), 74. https://doi.org/10.22201/fq.18708404e.2021.2.75875
Coaching, A. (2023). Factors Affecting Enzyme Catalysis. Ahmad Coaching. https://www-ahmadcoaching-com.translate.goog/2021/01/factors-affecting-enzyme-catalysis.html?m=1&_x_tr_sl=en&_x_tr_tl=es&_x_tr_hl=es&_x_tr_pto=tc
Kaiser, G. (2025.). Factors Affecting Enzyme Activity. LibreTexts. pg8 https://bio.libretexts.org/Courses/Prince_Georges_Community_College/PGCC_Microbiology/07%3A_Microbial_Metabolism/7.01%3A_Introduction_to_Metabolism_and_Enzymes/7.1.01%3A_Factors_Affecting_Enzyme_Activity
Nelson, D. L., & Cox, M. M. (2021). Lehninger Principles of Biochemistry (8th ed.). W.H. Freeman and Company.
Murray, R. K., Bender, D. A., Botham, K. M., Kennelly, P. J., & Rodwell, V. W. (2021). Harper: Bioquímica ilustrada (31.ª ed.). McGraw-Hill Education.
