Factores determinantes en las reacciones catalizadas por enzimas
Las reacciones catalizadas por enzimas están reguladas por diversos factores que influyen directamente en su velocidad y eficiencia. Comprender estos determinantes es fundamental para interpretar procesos metabólicos y aplicar principios bioquímicos en contextos clínicos. A continuación, se analizan algunos de los factores más relevantes.
Temperatura:
La temperatura afecta la energía cinética de las moléculas y, por lo tanto, la
frecuencia de colisión entre enzima y sustrato. En condiciones fisiológicas,
las enzimas humanas tienen una temperatura óptima alrededor de los 37 °C. Si
esta temperatura aumenta demasiado, la estructura terciaria de la enzima puede
alterarse, lo que produce desnaturalización e inactivación funcional. Por otro
lado, temperaturas bajas disminuyen la actividad catalítica, aunque de forma
reversible.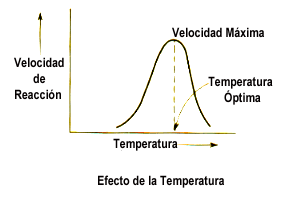
pH:
Cada enzima posee un rango óptimo de pH en el cual su actividad catalítica es
máxima. Alteraciones en el pH modifican la ionización de los grupos funcionales
tanto en el sitio activo como en el sustrato, lo que puede interferir en su
unión. Por ejemplo, la pepsina actúa de forma óptima en un pH ácido, mientras
que la mayoría de las enzimas citosólicas requieren un pH cercano a la
neutralidad. Cambios extremos de pH pueden desnaturalizar la proteína.
Concentración de enzima y sustrato:
La velocidad de una reacción enzimática aumenta al incrementar la concentración
de sustrato, pero solo hasta que los sitios activos de la enzima se saturan,
momento en el que la velocidad alcanza su valor máximo (Vmáx). A este
comportamiento se le describe mediante la cinética de Michaelis-Menten. Por
otro lado, si se aumenta la concentración de la enzima, la velocidad también se
incrementa, siempre y cuando haya suficiente sustrato disponible.
En conclusión, las condiciones fisicoquímicas como la temperatura y el pH, así como la disponibilidad de sustrato y enzima, son factores críticos para el funcionamiento enzimático. Mínimos cambios en estos parámetros pueden potenciar o inhibir drásticamente la actividad catalítica, afectando así procesos celulares vitales.

Referencias
Devlin, T. M. (2019). Bioquímica con aplicaciones clínicas (7.ª ed.). McGraw-Hill Education.
Harper, D. A., Rodwell, V. W., Bender, D. A., Botham, K. M., Kennelly, P. J., & Weil, P. A. (2018). Bioquímica ilustrada de Harper (31.ª ed.). McGraw-Hill Education.
Nelson, D. L., & Cox, M. M. (2021). Lehninger: Principios de bioquímica (8.ª ed.). Reverté.
