Equilibrio Ácido – Base
Para mantener la homeostasis, el cuerpo humano realiza numerosas adaptaciones fisiológicas. Una de ellas es el mantenimiento del equilibrio ácido-base. Una introducción para abarcar esta temática es explicar de que trata el Ph, es la medida del grado de acidez o alcalinidad de una sustancia o una solución. El pH se mide en una escala de 0 a 14. En ausencia de estados patológicos, el pH del cuerpo humano oscila entre 7,35 y 7,45, con un promedio de 7,40. Debido a la importancia de mantener un nivel de pH dentro del estrecho rango necesario, el cuerpo humano posee mecanismos compensatorios.


Este equilibrio se logra mediante la regulación de la producción y excreción de ácidos y bases, así como la acción de sistemas tampón. La alteración del equilibrio ácido-base puede tener graves consecuencias en la salud, incluyendo la pérdida de función celular y la muerte. Es muy importante porque para mantener este equilibrio el organismo es capaz de utilizar varios mecanismos, entre los cuales están:
· Mantenimiento de la homeostasis:
El equilibrio ácido-base ayuda a mantener un pH estable en la sangre y los tejidos, lo que es crucial para el correcto funcionamiento de las enzimas y otros procesos bioquímicos.
· Funcionalidad celular:
Un pH adecuado en los fluidos corporales es esencial para la supervivencia y el buen funcionamiento de las células.
· Interpretación de gases sanguíneos:
El equilibrio ácido-base se evalúa mediante la interpretación de los gases sanguíneos, lo que permite evaluar el estado respiratorio y metabólico del paciente.
El cuerpo regula este equilibrio mediante sistemas tampón, los pulmones y los riñones, asegurando así la estabilidad del medio interno. Clínicamente, desequilibrios como la acidosis o alcalosis (metabólica o respiratoria) se asocian a múltiples patologías y su detección, a través de gasometrías arteriales, es clave en el diagnóstico y tratamiento de enfermedades graves.
Producción de amortiguadores, buffers o tampones.
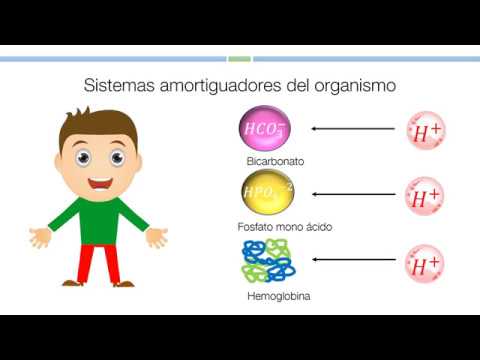
Una solución tampón, también conocida como solución amortiguadora o solución buffer, juega un papel crucial en la biología y la medicina. Este tipo de solución es una mezcla acuosa diseñada para mantener un pH relativamente constante, incluso cuando se añaden ácidos o bases adicionales. Esto se logra mediante la presencia de un ácido débil y su base conjugada, o una base débil y su ácido conjugado, en la misma solución. La solución tampón puede neutralizar tanto los ácidos como las bases añadidas, lo que ayuda a mantener el pH estable.
En el cuerpo humano, las soluciones tampón son esenciales para mantener un ambiente interno constante, lo que se conoce como homeostasis.
Es así que los sistemas amortiguadores pueden ser:
a) Sanguíneos: donde interviene proteínas como la hemoglobina (Hb), oxihemoglobina (HbO2), sistema bicarbonato (HCO3 /H2CO3), sistema fosfato (H2PO" 4/HPO2-4).
b) Plasmáticos e intersticiales: donde intervienen el sistema bicarbonato (HCO3/H2CO3).
c) Intracelulares: donde intervienen predominantemente el sistema fosfato (H2PO"4/HPO22-4) y las proteínas (Hb/HbO2).3
MECANISMO DE REGULACIÓN DE LOS AMORTIGUADORES BICARBONATO
Normalmente, el producto del metabolismo de las células, es la producción de protones, que son sustancias acidas, que, de no ser eliminadas, aumentarían la acidez del espacio intersticial y del plasma. Así producidos los ácidos, el primer sistema en intervenir es el del bicarbonato que usa su base conjugada logrando la formación de ácido carbónico, el que circula por el torrente circulatorio, llegando a los pulmones, donde se descompone por acción de la anhidrasa carbónica, en agua y dióxido de carbono (H2O + CO2), siendo este último eliminado por los pulmones.
Este sistema amortiguador bicarbonato, básico e importante, puede en algún momento, ser superado por la producción de ácidos, y el consumo de toda la fuente de bicarbonato, activando de esta manera la reposición de dicho anión a nivel renal, sistema fisiológico que empieza a extraer del cuerpo el bicarbonato en forma de H2CO3, el que por acción de la misma anhidrasa carbónica, disocia a esta molécula, convirtiéndola en HCO3 más hidrogeniones (H+), esta última sustancia se intercambia por sodio (Na), de forma tal, que por cada molécula de Na filtrada, se elimina un hidrogenión por la orina, acidificando de esta forma, este fluido orgánico, el cual deberá de igual forma que todos los fluidos del cuerpo, mantener un pH óptimo, que en su caso es de aproximadamente 6, el que puede sin embargo, ser modificado en caso de excreciones exageradas o insuficientes de hidrogeniones, lo que producirá cambios en la fisiología renal.
MECANISMO DE REGULACIÓN DE LOS AMORTIGUADORES FOSFATO
Si bien el pH corporal, permite la vida mientras se encuentre entre 7,00 y 7,80, los procesos relacionados a acidosis se encuentran con un pH menor a 7,35, mientras que la alcalosis se presenta cuando el pH supera los 7,45, con las consiguientes alteraciones respiratorias y metabólicas.
El sistema de amortiguación de los fosfatos, permite de igual forma, pero con menor participación, la regulación del pH sanguíneo, a través de la formación del fosfato monoácido (HPO42) en fosfato diácido (HPO4-) que será excretado por la orina, el protón eliminado será intercambiado de la misma manera como se explicó anteriormente, por un ion Na.
MECANISMO DE ACCIÓN DEL SISTEMA REGULADOR DE LAS PROTEÍNAS
Las proteínas involucradas en la formación y transporte del ácido carbónico, se orientan principalmente a la hemoglobina, elemento que participa en forma importante en la amortiguación de las sustancias. Es de esta forma, que la desoxihemoglobina se convierte en un regulador de mejor calidad que la oxihemoglobina, en el sentido que la capacidad de captación de oxígeno por los tejidos mejora la capacidad de regulación de la Hb, constituyéndose en la proteína de mejor y mayor capacidad de tampón, en relación a otras proteínas plasmáticas.
Conclusión:
El equilibrio ácido-base es fundamental para el funcionamiento óptimo del organismo, ya que permite mantener un pH constante que favorece la actividad enzimática, la estabilidad celular y la homeostasis general. Para lograrlo, el cuerpo cuenta con sofisticados sistemas amortiguadores, como el bicarbonato, las proteínas y los fosfatos, que actúan neutralizando los excesos de ácidos o bases. Estos buffers no solo se encuentran presentes de manera natural, sino que son constantemente regulados por órganos como los pulmones, los riñones y el hígado, adaptándose a las demandas metabólicas del organismo. La comprensión de estos mecanismos no solo es esencial para la medicina clínica, donde los desequilibrios pueden ser indicadores de enfermedades graves, sino también para la investigación biomédica, que busca nuevas estrategias terapéuticas basadas en la regulación del pH corporal.
Referencias:
Bustamante, G. & Cordón, C. (2014) Amortiguadores (Buffers). http://revistasbolivianas.umsa.bo/scielo.php?script=sci_arttext&pid=S2304-37682014000100003&lng=en&nrm=iso
Guyton, A. C., & Hall, J. E. (2021). Tratado de fisiología médica (14.ª ed.). Elsevier.
Hopkins, E., Sanvictores, T. & Sharma, S. (2022) Fisiología, equilibrio ácido-base. https://www.ncbi.nlm.nih.gov/books/NBK507807/
Instituto Nacional de Cáncer. (s.f) pH. https://www.cancer.gov/espanol/publicaciones/diccionarios/diccionario-cancer/def/ph
Murray, R. K., Bender, D. A., Botham, K. M., Kennelly, P. J., Rodwell, V. W., & Weil, P. A. (2022). Bioquímica Ilustrada de Harper (32.ª ed.). McGraw-Hill Education.
Universidad de Navarra (2023) Solución tampón. https://www.cun.es/diccionario-medico/terminos/solucion-tampon
